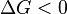En termoquimica, una reacción endergónica (también llamada reacción desfavorable o no espontánea) es una reacción química en donde el incremento de energía libre es positivo.
Bajo condiciones de temperatura y presión constantes, esto quiere decir que el incremento en la energía libre de Gibbs estándar debe ser positivo
para una reacción en estado estándar (a una presión estándar (1 bar), y unas concentraciones estándar (1 molar) de todos los reactivos y productos).
Constante de equilibrio
Las reacciones endergónicas se manifiestan durante los procesos anabólicos; de manera que, requieren que se le añade energía a los reactivos (sustratos o combustibles metabólicos), se le suma energía (contiene más energía libre que los reactivos). Por otro lado, durante las reacciones exergónicas se libera energía como resultado de los procesos químicos (ej, el catabolismo de macromoléculas). La energía libre se encuentra en un estado organizado, disponible para trabajo biológico útil. Las reacciones endergónicas se llevan a cabo con la energía liberada por las reacciones exergónicas. Las reacciones exergónicas pueden estar acopladas con reacciones endergónicas. Reacciones de oxidación-reducción (redox) son ejemplos de reacciones exergónicas y endergónicas acopladas.
Haciendo que las reacciones endergónicas transcurran
Las reacciones endergónicas pueden transcurrir si se 'empuja' o 'tira' de ellas con un proceso exergonico(aumentando de estabilidad, lo que produce un incremento negativo de la energía libre).
Tirando de la reacción
Se puede 'tirar' de los reactivos a través de una reacción endergónica, si los productos de la reacción desaparecen rápidamente debido una reacción exergónica subsiguiente. La concentración de los productos de la reacción endergónica debe mantenerse siempre baja para que la reacción habiendo alcanzado el estado de transición, se ve rápidamente involucrada en un proceso exergónico hasta un estado final mas estable.
Empujando la reacción
Una reacción endergónica se puede 'empujar' acoplándola a otra reacción que sea fuertemente exergónica, a través de un intermediario compartido.
Esto es frecuente en las reacciones biológicas. Por ejemplo la reacción

puede ser demasiado endergónica para que tenga lugar. Sin embargo, es posible que acoplándola a una reacción fuertemente exergónica – como, muy a menudo, es la descomposición de ATP en ADP y fosfato inorgánico, ATP → ADP Pi, así que


En este tipo de reacciones, con la descomposición de ATP se aporta la energía libre necesaria para que la reacción endergónica transcurra, es por esto frecuente que en bioquímica celular se llame al ATP "moneda universal de energía" de todos los oraganismos vivos.